Hinweise zur Nachweispflicht für vergünstigte Education-Produkte
Der Hersteller gewährt bezugsberechtigten Kunden aus dem Bildungsbereich für dieses Produkt durch Vorlage eines geeigneten Nachweises vergünstigte Education-Konditionen. Der EDU-Preis gilt nur für Kunden mit Rechnungs- und Lieferanschrift in Deutschland.
Wie kann ich zum EDU-Preis bestellen?
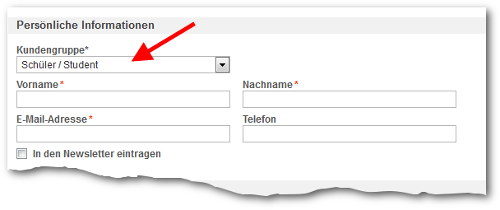
Um zum EDU-Preis bestellen zu können müssen Sie sich einmalig in unserem Shop registrieren (hier klicken). Bitte wählen Sie die Kundengruppe "Schüler / Student" oder als Lehrkraft den jeweiligen Schultyp aus.
Wer ist berechtigt?
- Lehrkräfte und Dozenten allgemeinbildender Schulen, Universitäten und Fachhochschule
- wissenschaftliche Mitarbeiter an Universitäten und Fachhochschulen
Bei Produkten der Marke Apple muss die Lieferung an die Schule / Universität erfolgen. Eine separate Rechnungslegung an z.B. eine Privatadresse, Verein oder Firma ist zulässig.
Das EDU-Programm gilt nur für Deutschland.
Welcher Nachweis wird anerkannt?
Schüler und Studenten
- gültiger Schülerausweis mit aktuellem Gültigkeitszeitraum (beide Seiten)
- Immatrikulations-Bescheinigung mit aktuellem Gültigkeitszeitraum
- Zulassungsbescheid für bevorstehendes Studium
- Minderjährige benötigen eine Eiverständniserklärung der Eltern
Lehrkräfte und Dozenten allgemeinbildender Schulen, Universitäten und Fachhochschulen
- Erste Seite des Arbeitsvertrages oder
- Bescheinigung der Bildungseinrichtung
wissenschaftliche Mitarbeiter an Universitäten und Fachhochschulen
- Erste Seite des Arbeitsvertrages oder
- Bescheinigung der Bildungseinrichtung
Wie erfolgt die Nachweisübermittlung?
Das Nachweisdokument kann vor oder nach der Bestellung zu uns übermittelt werden:
- bei Anlage eines Kundenkontos im Dynatech-Onlineshop über das Upload-Feld
- per Upload-Link direkt in der Bestell-Zusammenfassung
- per Fax: 036602-260 999 unter Angabe der Auftragsnummer
- per Post als Fotokopie an: Dynatech, Am Brand 4, 07580 Rückersdorf
Bei digitaler Übertragung verwenden Sie die Dateiformate *.pdf, *jpg, *.gif oder *.bmp.
Die Dokumente müssen vollständig lesbar sein und mindestens in Originalgröße vorliegen.
OK